» BLOG » Laboratoire et science » SOLVANTS : TYPES, USAGES ET IMPORTANCE DANS LES SCIENCES
Les solvants sont des substances chimiques largement utilisées et fondamentales dans de nombreux domaines scientifiques, notamment en chimie, biologie et pharmacie. Ces composés ont la capacité de dissoudre et de transporter des molécules en solution (appelées « solutés »).
Par exemple, dans les réactions chimiques, les solvants servent souvent de milieu réactionnel, tout en influençant directement la réactivité et les propriétés physiques et chimiques des solutions. Ils sont donc essentiels en recherche, en analyse ou pour le développement de nouveaux matériaux.
Dans cet article, nous explorerons ce que sont les solvants, leurs différents types, ainsi que quelques-unes de leurs utilisations les plus courantes en chimie et biologie, en soulignant leur importance dans la pratique scientifique.

Que sont les solvants et quels sont leurs types ?
Les solvants sont définis comme des substances capables de dissoudre un soluté, formant ainsi une solution dans laquelle le solvant constitue généralement la majeure partie du mélange. Bien qu’il existe des solvants gazeux, solides ou à l’état supercritique, les plus couramment utilisés en laboratoire sont les solvants liquides.
L’une des classifications les plus répandues des solvants se base sur leur polarité, c’est-à-dire la distribution des charges au sein de leurs molécules.
Solvants polaires : le cas de l’eau et autres exemples clés
Les solvants polaires possèdent des molécules à répartition inégale de charges, avec une zone partiellement négative et une autre partiellement positive. Cette polarisation leur permet d’interagir efficacement avec des solutés polaires ou ioniques, selon la règle « le semblable dissout le semblable ».
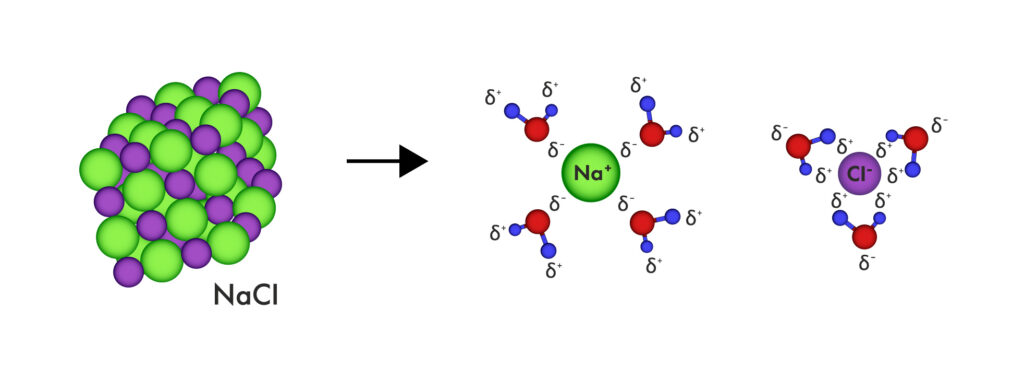
Schéma de la dissolution dans l’eau et de l’hydratation d’un cristal de chlorure de sodium (NaCl), le sel de table
Exemple : l’eau
L’eau est le solvant polaire le plus courant et le plus important biologiquement. Par exemple, le cytoplasme des cellules est majoritairement composé d’eau, dans laquelle se dissolvent (et se dispersent) de nombreuses molécules : sucres comme le glucose, ions comme le sodium ou le chlorure, et bien d’autres.
Même dans la vie quotidienne, ce phénomène est visible : lors de la cuisson, le sel de table (NaCl) se dissout facilement dans l’eau chaude grâce à sa polarité.
Autres exemples de solvants polaires :
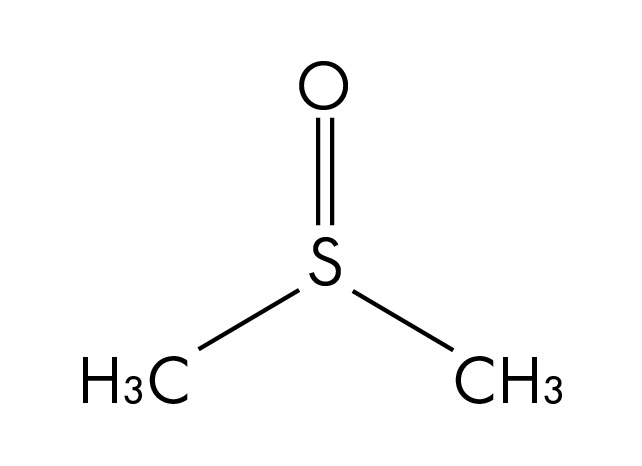
Structure moléculaire du diméthylsulfoxyde (DMSO), un solvant polaire aprotique
Solvants apolaires : milieu inerte pour réactions spécifiques
Les solvants apolaires présentent une répartition uniforme des charges électriques, ce qui leur permet de dissoudre des composés apolaires comme les graisses, cires ou hydrocarbures.
En chimie organique, pour certaines réactions très sensibles (impliquant des nucléophiles ou électrophiles), on privilégie les solvants chimiquement inertes. L’eau, par exemple, peut s’avérer trop réactive, car elle peut participer à des réactions acide-base ou agir comme nucléophile, ce qui peut entraîner la formation de produits secondaires indésirables. En revanche, les solvants apolaires ou polaires aprotiques, dépourvus de cette réactivité, favorisent des conditions de réaction plus propres et mieux contrôlées.
Exemples de solvants apolaires :
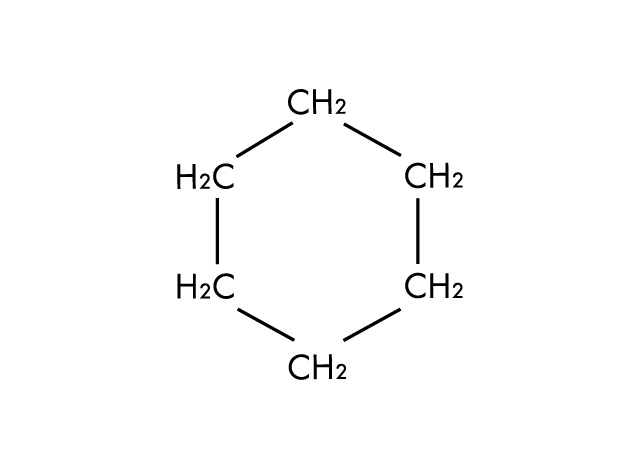
Structure moléculaire du cyclohexane, un solvant apolaire aprotique
Applications courantes en chimie et biologie
Les solvants jouent un rôle clé dans de nombreuses réactions en laboratoire. Parmi les usages les plus fréquents :
Les solvants agissent comme milieu de réaction où ont lieu de nombreuses réactions chimiques. Leur choix influence la solubilité des réactifs, la vitesse de réaction et le type de mécanisme (par exemple, SN1 ou SN2).
Des substances comme l’acétone ou l’éthanol sont couramment utilisées pour nettoyer le matériel en verre ou les surfaces, en raison de leur capacité à dissoudre les graisses, les polymères ou les contaminants.
En biologie, les solvants sont employés pour extraire des métabolites à partir de tissus. Parmi les exemples classiques :
Dans des techniques comme la chromatographie liquide à haute performance (HPLC) ou la chromatographie sur couche mince (CCM), les solvants agissent comme phases mobiles (éluants).

Conclusions
Les solvants sont des outils chimiques essentiels dans tout laboratoire. De la dissolution de substances inorganiques dans l’eau à l’extraction de lipides ou d’alcaloïdes, ils possèdent une multitude d’applications, et leur rôle est déterminant en chimie, en biologie, et dans bien d’autres disciplines scientifiques.
Attention
Les produits chimiques Labkem sont exclusivement destinés à un usage en laboratoire et leur manipulation doit être effectuée uniquement par des professionnels du secteur. Les produits chimiques étant dangereux, veuillez respecter les instructions figurant dans la fiche de sécurité. Les fiches de sécurité peuvent être téléchargées gratuitement sur notre site web www.labbox.fr
Chez Labbox, nous proposons une large gamme de solvants pour différentes applications scientifiques sous la marque Labkem.